近日,渤健开发的β-淀粉样蛋白抗体阿杜卡尼单抗(aducanumab)再遭FDA委员会的抨击,这是继2020年11月对该药提出反对意见后的又一次“打击”,这为阿杜卡尼单抗能否上市又蒙上了一层迷雾。
在机制尚不明朗的情况下去做新药研发,各家研发机构无疑是在“赌”。从近年来多家知名药企的阿尔茨海默症临床试验失败案例中也足见这一领域药物研发之难。
关于阿尔茨海默症的致病机制,业界普遍比较认同大脑中的β-淀粉样蛋白和tau蛋白与疾病发生有关。异常水平的β-淀粉样蛋白会形成大脑神经元之间的斑块,扰乱细胞功能,而tau蛋白在神经元内的积累会形成神经纤维缠结,阻塞神经元的传输系统。
但这些蛋白积累的原因和它们彼此之间的关系目前仍不清楚。虽然大部分疗法在减少异常蛋白的积累上进行调节,但基本都失败了,而且部分用于防止患者大脑损伤的药物也几乎没有任何实际性的益处。
除了利用传统的小分子和抗体疗法靶向有害蛋白,研发人员还转向从转录水平或基因水平尝试治疗阿尔茨海默症。
Science Advance在3月份发表了两篇相关的研究论文,提供了一些药物研发的新思路。
靶向基因转录
在一项研究中,美国马萨诸塞州神经退行性疾病研究所和Sangamo Therapeutics等机构的研究人员利用锌指蛋白转录因子(ZFP-TF)在转录水平上降低了tau基因MAPT的表达,挽救了阿尔茨海默症小鼠模型中淀粉样斑块周围的神经元损伤。
ZFP-TF 的结构如下图,ZFP-TF能靶向特定的DNA序列,与TF融合可抑制靶基因转录。
利用AAV载体,在小鼠大脑海马区单次给药或经静脉注射后,药物选择性地将tau mRNA和蛋白质降低了50%至80%,而且tau蛋白持续降低,没有发现脱靶效应。
此前,通过反义寡核苷酸(ASO)疗法结合tau mRNA阻止蛋白翻译或通过静脉注射抗tau抗体可以沉默tau蛋白的表达,但这两种方法都需要对患者进行长期给药,并且广泛性基因沉默的能力有限。ZFP-TF在小鼠中所实现的对内源性tau基因高度特异性、持久性和可控性的沉默显示了这一工具治疗人类tau蛋白相关疾病的希望。
作用于神经修复
第二项研究来自剑桥大学的一个研究团队,研究人员并没有沿着经典假说进行药物开发,而是通过促进轴突分泌治疗性蛋白修复受损的神经元。
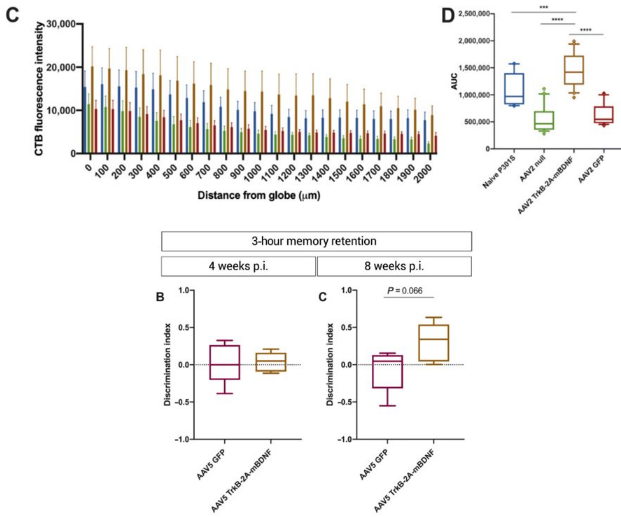
轴突传输的中断是神经退行性疾病的常见特征,研究团队所开发的这种基因疗法能表达两种治疗性蛋白,分别为脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)及其受体肌球蛋白受体激酶B(Tropomyosin receptor kinase B, TrkB)。
BNDF和TrkB共同促进轴突的传输过程,帮助线粒体、脂质,蛋白质和其它关键元素在神经元细胞之间移动,使神经细胞能够与其它神经细胞和肌肉进行交流。
与单独的受体或配体相比,联合使用BDNF和TrkB替代治疗表现出了更高的疗效。在阿尔茨海默症小鼠模型中,这种基因疗法增加了大脑中的轴突运输,而且通过迷宫实验测试还发现这一疗法改善了小鼠的短期记忆。
此前基因疗法很难在阿尔茨海默症中应用,主要原因是这类疾病是由多基因异常所引发的,单次只调控一个基因的表达往往无法达到显着的治疗效果。而这项研究显示了靶向内在神经元机制来改善神经元修复是一种有希望的治疗策略。声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com
