CAR-T细胞疗法治疗血癌已经取得了一定的成功,但在实体瘤上的应用还存在很多局限性。过表达的肿瘤相关抗原(如EGFR和HER2)是治疗性T细胞有吸引力的靶点,但CAR-T细胞可能与表达低水平靶抗原的正常组织发生毒性交叉反应,这种脱靶副作用是阻碍CAR-T发展的一大障碍。
近期,美国加州大学旧金山分校与芬兰赫尔辛基大学的研究人员合作,设计了一个两步正反馈电路,即给CAR-T细胞加了一个开关,可让其根据S型曲线抗原密度阈值来区分靶标,从而避免CAR-T细胞对表达低水平肿瘤抗原的正常细胞误杀,也为攻克实体瘤提供了一个关键性工具。相关成果发表在Science上。
在该电路设计中,研究人员利用一种名为synNotch的受体来检测HER2抗原表达。低亲和力synNotch受体作为一个过滤器,限制转录诱导只发生于T细胞遇到高抗原表达靶细胞时。而一旦通过这个初始过滤器,诱导的高亲和力CAR就能进行强效的T细胞增殖和杀伤。
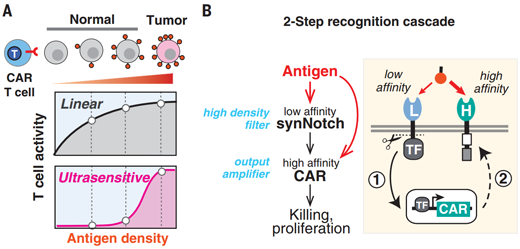
图2 | 超灵敏抗原密度感应T细胞的设计。(A)理想的治疗性T细胞将区分表达高抗原密度的肿瘤细胞和表达低抗原量的正常细胞。具有标准线性响应曲线的CAR-T细胞在高密度和低密度细胞之间的区别效果很差。有效的区别需要一条S型超灵敏剂量-反应曲线。(B)两步识别电路的设计。TF = 转录因子。(来源:Science)
具体来说,考虑到T细胞电路的应答可以通过改变电路内的受体亲和力来调节,研究人员通过连接低亲和力和高亲和力识别,形成两步级联反应来产生稳健的超灵敏响应。低亲和力synNotch受体遇到低密度HER2抗原时,在T细胞表面表达很少量CAR(图3下左)。相反,当该受体遇到高密度HER2抗原时,它们被更好地激活从而表达更高稳态量的CAR(图3下右)。因此,高密度靶抗原既增加了CAR的表达水平,又激活了T细胞的增殖和杀伤活性。相比之下,对于组成型表达(constitutively expressed。与诱导性表达相对,组成型表达不需要其他因子的诱导即可稳定的表达)CAR的T细胞,即使是CAR表达降低,或CAR亲和力降低,也会触发T细胞对低抗原密度细胞的杀伤。
图3 | 在高亲和力CAR上表达低亲和力synNotch(synNotch低亲和力→ CAR高亲和力)的两步电路机理。(来源:Science)
研究人员解释道:“即便使用相同的抗原结合域,CAR和synNotch受体显示出不同的敏感性。CAR更敏感,以相对低的抗原密度触发杀伤活性,而synNotch介导的基因表达需要更高的抗原密度。因此,低亲和力 synNotch受体不能诱导足够量的CAR表达来触发低密度靶点的杀伤反应,而仅引发高密度靶点的强效杀伤。”
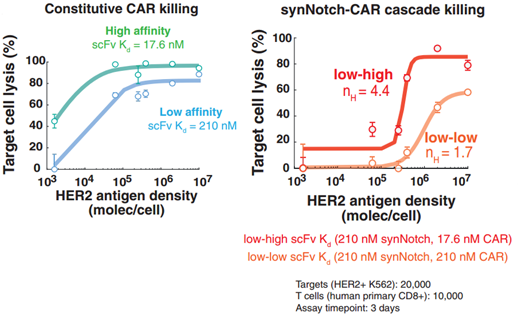
研究人员还评估了T细胞电路的设计是否可以实现HER2抗原的密度依赖性识别。结果显示,一些synNotch低亲和力→ CAR高亲和力电路T细胞显示HER2抗原密度超敏感(图4右)。相比之下,组成型表达高亲和力或低亲和力CAR的T细胞显示出很小的密度区分(图4左)。
图4来源:Science
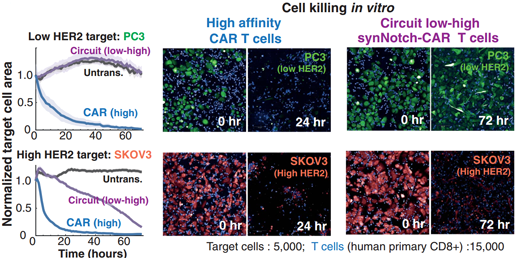
接下来,研究进一步检测了HER2抗原密度感应电路针对多种不同 HER2低表达和高表达的人癌细胞系的效果。
体外杀伤实验显示,对于低密度HER2表达的细胞,未转化的T细胞和电路T细胞在72小时内均未显示细胞毒性(图5)。
图5来源:Science
对于高密度HER2表达细胞,电路T细胞能有效进行杀伤。
体内研究显示,在小鼠肿瘤模型中,电路T细胞显示出很强的密度分辨力(图6):高密度HER2表达肿瘤被迅速清除,但低密度HER2表达肿瘤的生长速度与接受未转化T细胞处理的相似。
图6 | synNotch低亲和力→ CAR高亲和力电路T细胞在小鼠模型中的抗原密度鉴别。(来源:Science)
对于这些实验结果,研究团队表示非常兴奋,进一步的研究已经开始起步。文章作者之一、赫尔辛基大学的Anna Mäkelä博士说:“我们正在进一步开发该技术,以将其应用于治疗卵巢癌等实体肿瘤。随着研究的进展,我们的目标是开发靶向更多抗原的CAR结构,再结合该技术,从而应用于更多的实体肿瘤。这就像‘多弹头导弹’一样,癌细胞将难以抵抗。”
虽然,CAR-T实现真正攻克实体瘤,还需要克服其他几个挑战,包括肿瘤异质性、抑制性肿瘤微环境,以及改善T细胞向肿瘤的输送等,但是这项研究实现了CAR-T超灵敏区分肿瘤抗原密度的能力,为扩大CAR-T对实体瘤的治疗范围(找到低门槛而广泛的靶点)提供了关键性工具。
参考资料:
1# Rogelio A. Hernandez-Lopez et al. T cell circuits that sense antigen density with an ultrasensitive threshold. Science. (2021)
2# A leap forward in research on CAR T cell therapy(来源:Medical press)
3# Cellular Engineering Boosts CAR-T Therapy against Solid Tumors(来源:Genetic Engineering & Biotechnology News)
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com