阿尔茨海默症(Alzheimer’s disease, AD),俗称老年痴呆症,其病理特征为认知功能衰退、记忆损伤,是一种神经退化性疾病。仅在中国,估计就有超过50万名患有遗传性AD的患者,即家族性阿尔茨海默症(Familial Alzheimer's Disease, FAD),这是一种与家族史高度相关的先天性AD。尽管 FAD 有明确的遗传原因,并且可以在认知问题出现之前就被诊断出来,但目前对其还没有有效的治疗方法。

ALZEIMER 来源:andoni63
家族性阿尔茨海默症(FAD)
家族性阿尔茨海默症(FAD)的病症是由淀粉样β前体蛋白 (amyloid-beta precursor protein, APP) 的基因编码,以及早老素1和早老素2(presenilin 1 and presenilin 2)的基因编码的三者基因显性突变引起的,其病理特征是多个脑区中存在细胞外淀粉样斑块(extracellular amyloid plaques)和细胞内神经原纤维缠结(intracellular neurofibrillary tangles)。
由香港科技大学 (Hong Kong University of Science and Technology, HKUST) 叶玉如教授带领的国际化研究团队开发出了一种使用全脑基因组编辑技术的新策略,其可以减少转基因阿尔茨海默症小鼠模型的病症。这项先进的技术具有巨大的潜力,可以转化为一种新的长效治疗AD患者的方法。

一劳永逸的基因组编辑
使用基因组编辑技术为策略来治疗遗传突变引起的疾病(如FAD)是具有巨大潜力的。对于在症状出现之前,纠正那个引发疾病的基因突变,它尤其有用。因此,它被认为是一个“一劳永逸”的治疗方法,因为它的效果可以持续一生。
障碍
然而,一些障碍阻碍了它的临床开发和应用——显着的一点就是其缺乏有效、高效和非侵入性的方法来将基因组编辑剂输送到大脑中。此外,现有的基因组编辑技术还无法针对全脑产生有益的结果。
研究突破
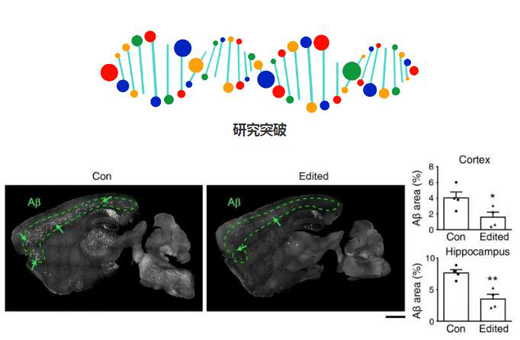
淀粉样蛋白水平(绿色虚线包围区域中的白色阴影) - 是认为导致阿尔兹海默症(AD)里神经退化的蛋白质,在AD小鼠(左图)大脑中很高,但在整个大脑中进行过基因组编辑治疗后的小鼠(右图)大脑中有明显降低。
来源:香港科技大学
单次静脉注射
而近期,香港科技大学研究与发展(Research and Development at HKUST)副校长、中科院院士叶玉如教授的团队开发出的新的基因组编辑系统不仅可以跨越血脑屏障(blood-brain barrier),还可以为整个全脑提供优化的基因组编辑工具。该策略通过使用新设计的基因组编辑运输载体,实现了通过单次非侵入性静脉注射即可高效地对全脑实行基因组编辑。这有效地破坏了AD小鼠模型中由FAD引起的突变,并改善了整个大脑的AD病症,为该疾病的新型治疗方法的发展铺平了道路。
持久影响
同时,研究小组在小鼠模型中还发现,淀粉样蛋白(驱动AD神经退化的蛋白质)在治疗后6个月内维持低水平(约占小鼠正常寿命的1/3),这表明单次的基因组编辑策略具有持久的影响。更重要的是,到目前为止,在小鼠中还没有检测到副作用。
“作为有效的全脑基因组编辑以缓解整个大脑的阿尔茨海默症病症的首次示范,这确实是一个令人兴奋的发展,”同时也是香港科技大学晨兴生命科学的教授和分子神经科学国家重点实验室主任的叶教授说(Morningside Professor of Life Science and Director of the State Key Laboratory of Molecular Neuroscience at HKUST):“我们的工作对使用基因组编辑治疗遗传性脑疾病是一个重要里程碑,并有助于针对遗传性神经退化性疾病的精准医学的研究发展。”
合作和发表
这项研究是来自多个大学的科学家的合作成果;包括香港科技大学(HKUST),加州理工学院(California Institute of Technology);以及中国科学院深圳先进技术研究院(Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences)。
近期,该研究团队将他们的研究成果发表在了《Nature Biomedical Engineering》期刊上,研究论文名为“Brain-wide Cas9-mediated cleavage of a gene causing familial Alzheimer’s disease alleviates amyloid-related pathologies in mice”。

论文官网截图
具体成果及方法
该研究团队展示了,在携带人类APP瑞典突变(human APP Swedish mutation)的转基因小鼠模型中,在全脑范围内选择性破坏突变的APP等位基因(mutated APP allele)可在单次海马内施用编码Cas9和靶向突变的单向导RNA的腺相关病毒(adeno-associated virus that encodes both Cas9 and a single-guide RNA that targets the mutation),缓解了淀粉样蛋白 β(amyloid-beta)相关病症至少六个月。
该研究团队还展示了,当CRISPR-Cas9构建体通过一种可以穿过血脑屏障(blood–brain barrier)的改良的腺相关病毒(a modified adeno-associated virus)静脉传递时,淀粉样蛋白β(amyloid-beta)的沉积以及小胶质细胞增生、神经突营养不良和认知能力受损都可以得到改善。全脑改良疾病基因组编辑(brain-wide disease-modifying genome editing)可能是可以代表治疗家族性阿尔茨海默症(FAD)和其他影响多脑区域的单基因疾病的一个可行策略。
声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com



