癌变的细胞会产生在健康细胞中看不到的突变蛋白质。这些癌性蛋白质,也被称为新抗原,可以警醒身体的免疫系统。随后,识别这些新抗原的 T 细胞开始杀伤癌细胞。,肿瘤会产生一种免疫抑制环境使 T 细胞失活,也就是所谓的“T 细胞耗竭”现象,从而帮助肿瘤不受抑制地生长。
新抗原可以驱动有效的抗肿瘤 T 细胞反应。在过去十多年里,科学家们一直在探索通过疫苗接种来帮助对抗癌症,这些实验性疫苗旨在通过注射在肿瘤中发现的癌性蛋白质片段来刺激人体自身免疫系统以摧毁肿瘤。然而,在大多数癌症中,T 细胞对新抗原的反应性受到明显限制,目前这些癌症疫苗也没有获批上市。
2021年9月16日,麻省理工学院的研究团队在国际前列学术期刊 Cell 上发表了题为:Antigen dominance hierarchies shape TCF1+ progenitor CD8 T cell phenotypes in tumors 的研究论文。
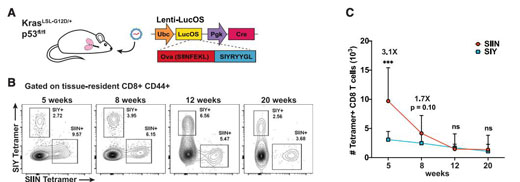
该研究发现,针对某些肿瘤新抗原进行疫苗接种可以增强整体 T 细胞反应并有助于缩小小鼠体内肿瘤,这项研究有助于确定癌症疫苗中应当包含哪些蛋白质,针对研究中发现的蛋白质进行疫苗接种,可以帮助唤醒靶向这些蛋白质的休眠 T 细胞群,从而加强整体免疫反应。研究团队先前构建了KRAS/p53驱动(KP)的原位肺腺癌小鼠模型,以表达肿瘤特异性新抗原。来自SIIN和SIY两种模型的 CD8 T 细胞新抗原以与荧光素酶融合的形式在肿瘤细胞中表达,也被称为LucOS。在LucOS模型中,SIIN和SIY同时表达,为研究不同新抗原特异性CD8 T细胞在抗肿瘤反应中的相互作用提供了一个实验模型。

首先,研究团队对KP-LucOS小鼠肺肿瘤中的SIIN-和SIY-特异性CD8 T细胞进行了纵向表征。在反应高峰时,与SIY相比,SIIN可显著促进CD8 T细胞的扩增。此后SIIN反应急剧收缩,而SIY反应随着时间的推移持续发展,导致SIIN和SIY特异性细胞数量趋等。随着时间的推移,这两个群体越来越多地表现出功能障碍的特征,但是SIY特异性细胞表现出较慢的功能障碍动力学。
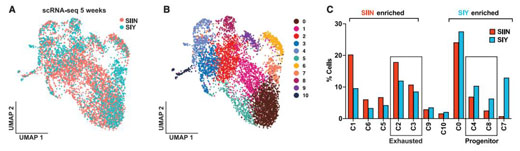
为了深入研究SIIN-和SIY-特异性CD8 T细胞之间的表型差异,研究团队在反应高峰时进行了单细胞RNA测序(scRNA-seq)和配对T细胞受体(TCR)测序。结果显示,SIIN特异性细胞因“效应器”和“耗尽”T细胞特征而富集,而SIY特异性细胞因分化程度较低的“幼稚”和“记忆前体”状态(具有TCF1+祖细胞特征)而富集。
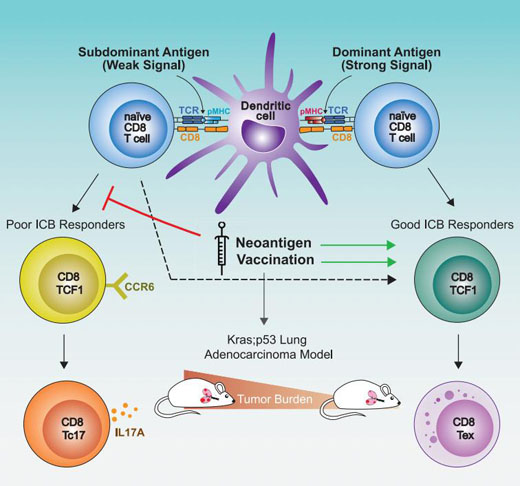
研究团队发现,抗原优势层次可以在肿瘤中形成,这会显着影响对亚优势抗原作出反应的细胞表型。与 SIIN 的竞争促进了SIY 特异性细胞之间的 TCF1 +祖细胞表型,并阻碍了向效应细胞和衰竭细胞状态的分化。ICB治疗肿瘤小鼠的实验中,SIY 群体反应更差,原因在于亚优势 CD8 T 细胞反应富含 一种从未被描述过的CCR6 + TCF1 +祖细胞亚群,这种亚群代表了功能降低的非常规 TCF1 +群体。
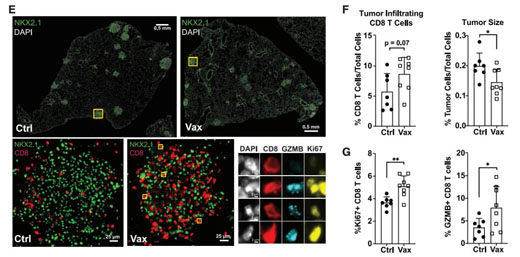
当研究团队给患有肺部肿瘤的小鼠接种 SIIN 或 SIY 疫苗后,发现肿瘤平均缩小了 27%。接种疫苗后,CD8 T 细胞增殖和细胞毒性增加,持续为反应补充燃料,而CCR6+的群体显著被抑制,从而达到了长期控制肿瘤的效用,表明试图识别这些被抑制的反应并专门针对它们可能会改善患者对疫苗疗法的反应。
总的来说,这项工作发现了一个以前未被描述的祖细胞亚群,这是一群抗原亚优势群体,与功能受损和对免疫检查点阻断的不良反应相关。疫苗接种消除了该亚群并极大地增强了T细胞群体对肿瘤的攻击能力,突出了一种以较好方式进行针对肿瘤的亚新抗原反应的策略。

声明:本文版权归原作者所有,转载文章仅为传播更多信息,如作者信息标记有误,或侵犯您的版权,请联系我们,我们将在及时修改或删除内容,联系邮箱:marketing@360worldcare.com